2 Masse und Materie
2.1 Masse
Masse ist eine physikalische Größe, die die Trägheit von Materie beschreibt. Ein Gegenstand mit einer großen Masse lässt sich schwerere bewegen als einer mit einer kleineren Masse. Der Gegenstand mit der großen Masse ist also träger.
Masse lässt sich in einigen Fällen berechnen: 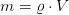
Dabei ist 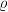 die Dichte eines Materials. Dichte hat in SI-Einheiten die Einheit
die Dichte eines Materials. Dichte hat in SI-Einheiten die Einheit 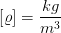 .
.
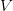 ist das Volumen der betrachteten Masse. In SI-Einheiten hat es die Einheit
ist das Volumen der betrachteten Masse. In SI-Einheiten hat es die Einheit 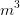 .
.
- Aufgaben dazu -
@Masse @Dichte @Volumen
2.2 Was ist Materie?
Alles um uns herum besteht aus Atomen und Molekülen. Ein Molekül ist eine Kombination aus miteinander fest verbundenen Atomen.
Alle Atomsorten, die es auf der Welt gibt, sind im sogenannten Periodensystem (www) aufgelistet. Auf dieser Seite lassen sich Periodensysteme in verschiedenen Auflösungen herunterladen.
Im Periodensystem sind alle bekannten Atomsorten nach ihrem Gewicht und nach chemischen Eigenschaften geordnet. Mehr dazu erfahren Sie in der Atomphysik (Klassenstufe 13.1).
@Periondensystem
2.3 Aggregatzustände
Materie gibt es in ganz unterschiedlichen Formen und mit ganz unterschiedlichen Eigenschaften, hart, weich, flüssig, gasförmig ... .
Fest, flüssig und gasförmig sind sogenannte Aggregatzustände der Materie. Die Aggregatzustände hängen natürlich auch von den Atomen und Molekülen ab. Wenn Atome oder Moleküle kaum etwas voneinander "merken" und weit voneinander entfernt sind, dann liegt gasförmige Materie vor. Wenn Atome oder Moleküle zwar eng beieinander aber noch beweglich sind, dann liegt eine Flüssigkeit vor. Flüssigkeiten haben zwar keine feste Form, aber sie sind auch nur sehr schwer komprimierbar. Wenn dagegen alle Atome oder Moleküle fest mit dem nächsten Nachbarn verbunden sind, dann liegt ein sogenannter Festkörper vor. (siehe Aufgaben)
@Aggregatzustände
2.4 Masse ist eine Erhaltungsgröße
Das heißt, dass Masse nicht erzeugt oder vernichtet werden kann, sie kann nur ihre "Form" ändern.
Es gibt manche Extremfälle in der Kernphysik, in denen diese Aussage etwas verallgemeinert werden muss. Es ist tatsächlich möglich aus einem Elementarteilchen und seinem Antiteilchen einen Energieblitz zu machen, oder dass aus sehr viel elektromagnetischer Energie ein Teilchen-Antiteilchen-Paar entsteht. Laut Einstein gibt es einen Zusammenhang zwischen Masse und Energie: E= m · c² . Das heißt in solchen Fällen kann zwar Masse scheinbar verschwinden, aber sie verwandelt sich dann in eine entsprechende Menge an Energie.
In unserer makoskopischen Welt ist Masse aber grundsätzlich eine Erhaltungsgröße.
2.5 Hier kann man die Zahlen finden:
- Tabelle mit der Dichte von Gasen (Wikibooks)
- Tabelle mit der Dichte von Flüssigkeiten (Wikibooks)
- Tabelle mit der Dichte von Feststoffen (Wikibooks)
2.6 Zahlenbeispiele
Eine atomare Masseneinheit ist 1u = 1,660 · 10-27 kg
Gase
Luft
Luft besteht zu 78% aus Stickstoff und 21% aus Sauerstoff.
Dichte: 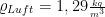
Da Sauerstoff und Stickstoff nicht als einfache Atome in der Luft vorkommen, sondern jeweils als ein Molekül aus zwei Atomen, werden im Folgenden die Moleküle betrachtet.
Sauerstoff:
Dichte: 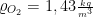 bei 0°C
bei 0°C
Masse eines Sauerstoffmoleküls O2 m02=32,0 u
Durchschnittlicher Durchmesser eines Sauerstoffmoleküls: 2,0 · 10-10 m
Stickstoff
Dichte: 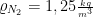 bei 0°C
bei 0°C
Masse eines Stickstoffmoleküls N2 mN2=28,0 u
Durchschnittlicher Durchmesser eines Stickstoffmoleküls: 1,9 · 10-10 m
Wasser
Dichte: 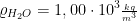
Masse eines Wassermoleküls: mH2O= 18,0 u
Durchschnittlicher Durchmesser eines Wassermoleküls: 3 · 10-10m = 0,3 nm
Eisen
Dichte: 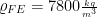
Masse eines Eisenatoms: mFe=55,8 u
Radius eines freien Eisenatoms r≈140 · 10-12m
2.7 Aufgaben zu Masse und Dichte
- Wie schwer ist 1 m³ Luft?
- Ein Wassertropfen hat etwa einen Durchmesser von 5mm. Wie schwer ist ein Wassertropfen?
- Ein Centstück besteht fast nur aus Eisen. Es hat einen Radius von r=8,125 mm und eine Dicke von 1,4 mm. Berechnen Sie: Wie schwer ist ein Centstück
2.8 Aufgaben zu Aggregatzuständen
Berechnen Sie mit den oben stehenden Zahlen:
Wie weit sind zwei Moleküle bzw. Atome von einander entfernt ...
- ... in Stickstoff (≈ Luft)
- ... in Wasser
- ... in Eisen
Wenn Sie nicht alleine auf den Rechenweg kommen, dann bekommen sie hier eine Hilfe
- Vergleichen Sie die Lösungen der Aufgaben a. bis c. und erläutern Sie, was diese Ergebnisse mit den Aggregatzuständen zu tun haben.
Backlinks:
2 Physikbücher:BGPhysik11-EP
