10 Was wir bis heute über Atome wissen
Kern und Hülle
Atome haben einen Kern, der aus positiv geladenen Protonen und elektrisch neutralen Neutronen besteht:
Um diesen Kern herum ist eine Hülle aus Elektronen, deren Durchmesser etwa das 10000-fache des Kerndurchmessers hat. Trotzdem macht der Kern mehr als 99,9% des Atomgewichtes aus. Elektronen sind immer negativ geladen. Atome sind nach außen neutral, daher gibt es in jedem Atom genau so viel Elektronen, wie es Protonen im Kern gibt. Sollte sich doch einmal ein Elektron zu viel oder zu wenig um einen Atomkern herum befinden, dann spricht man von einem Ion.
Elektronenhülle als Quantensystem
Die negativ geladenen Elektronen in der Atomhülle werden von dem positiv geladenen Atomkern angezogen. Sie können daher nicht "wegfliegen" und sind so vom Kern "eingesperrt" wie in einem Raum. Dieser "Raum" ist die potentielle Energie, die in die Schrödingergleichung eingesetzt wird, wenn man die Wellenfunktionen der Elektronen der Elektronenhülle berechnet (siehe hier).
Die Lösung der Schrödingergleichung für die Elektronen eines Atoms führt zu sogenannten Kugelflächenfunktionen. Jeder Kugelflächenfunktion ist durch die Lösung der Schrödingergleichung auch eine bestimmte Energie zugeordnet. Die Kugelflächenfunktionen, die zur gleichen Energie gehören, werden wiederum zu Atomorbitalen kombiniert.
Atomorbitale
Atomorbitale entstehen also letztendlich durch die Lösung der Schrödingergleichung für Atome. Ein Atomorbital beschreibt ein räumliches Gebiet um den Atomkern herum. Und zwar einen Bereich, in dem sich ein Elektron einer ganz bestimmten Energie mit einer Wahrscheinlichkeit von 90% aufhält. Die Wellenfunktionen der unterschiedlichen Atomorbitale haben bestimmte Parameter, die Quantenzahlen. Die Quantenzahlen geben jedem Atomorbital eine eindeutige "Hausnummer". In jedem Atomorbital können sich höchstens zwei Elektronen aufhalten.
Eine Elektronenhülle ist wie ein Hochhaus ohne Fahrstuhl. Niemand möchte oben wohnen, weil man dann so viele Treppen steigen muss. Die unteren Etagen werden daher zuerst besetzt. Genauso ist es bei Atomen, die inneren Atomorbitale mit den kleineren Energien werden zuerst von Elektronen besetzt. Allerdings passen in jedes Orbital nur 2 Elektronen, daher können nicht alle "unten wohnen". Man kann Elektronen dazu bringen, in höhere Stockwerke zu springen, wenn man ihnen Energie zuführt, durch Wärme, Licht oder elektrische Spannung.
Die Quantenzahlen
Man unterscheidet beiden Atomorbitalen folgende Quantenzahlen:
Hauptquantenzahl n
Die Hauptquantenzahl n beschreibt so etwas wie die verschiedenen Schalen einer Zwiebel. Die innerste Schale hat die Hauptquantenzahl n=1 und ab da wird nach außen aufwärts gezählt:
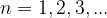
Bahndrehimpulsquantenzahl l
Die Bahndrehimpulsquantenzahl l beschreibt, welche Form ein Orbital hat. Es gibt in jeder "Schale" unterschiedlich viele Drehimpulsquantenzahlen:
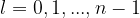
- Orbitale mit der Bahndrehimpulsquantenzahl l=0 heißen auch s-Orbitale
- Orbitale mit der Bahndrehimpulsquantenzahl l=1 heißen auch p-Orbitale
- Orbitale mit der Bahndrehimpulsquantenzahl l=2 heißen auch d-Orbitale
- Orbitale mit der Bahndrehimpulsquantenzahl l=3 heißen auch f-Orbitale
- Orbitale mit der Bahndrehimpulsquantenzahl l=4 heißen auch g-Orbitale
- Orbitale mit der Bahndrehimpulsquantenzahl l=5 heißen auch h-Orbitale
höhere Quantenzahlen treten eigentlich nicht auf.
Magnetquantenzahl m
Die Magnetquantenzahl m beschreibt, in welche Richtung der Koordinatenachsen x, y und z die Orbitale jeweils ausgerichtet sind: Folgende Magnetquantenzahlen sind möglich:
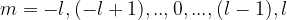
Spinquantenzahl s
Die Spiquantenzahl s kann nur zwei verschiedene Werte annehmen. und zwar 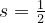 oder
oder 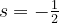 .
.
Der Spin eines Elektrons lässt sich anschaulich mit einer Eigenrotation vergleichen, wie dier Erde, die sich um ihre eigene Achse dreht. Auch wenn diese Anschauung der Wahrheit nicht ganz entsprechen mag, so kann man doch die gleiche Mathematik zur Beschreibung des Spins verwenden, wie beim Drehimpuls in der Mechanik. In jedes Atomorbital passen zwei Elektronen. Eines mit dem Spin 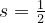 und eines mit em Spin
und eines mit em Spin 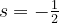 .
.
Atomorbitale sind schön
Auf dieser Internetseite kann man sich die Atomorbitale zu den unterschiedlichen Quantenzahlen ansehen:
https://winter.group.shef.ac.uk/orbitron/
Je höher die Quantenzahlenm, desto schöner die Orbitale.
Backlinks:
2 Physikbücher:BGPhysik13-1
2 Physikbücher:BGPhysik13-1:11 Das Periodensystem der Elemente
