12 Licht, Wärme und Farbe
Licht
Licht ist eine elektromagnetische Welle. Wenn es auf Elektronen trifft, verhält es sich wie ein Teilchen, ein Photon (-> Photoeffekt). Je nachdem, wie hoch die Frequenz bzw, wie groß die Wellenlänge des Photons ist, hat das Licht entweder eine andere Farbe oder es ist gar nicht zu sehen. Sichtbares Licht gibt es ja nur im Wellenlängenbereich von etwa 400 nm bis 800 nm. Wellenlängen, die darunter liegen sind zwar nicht sichtbar, aber solche Photonen kann man fühlen: Als Wärmestrahlung. Wenn man Licht aller Farben gleichzeitig leuchten lässt, dann erhält man weißes Licht. Gibt es kein Licht, so sehen wir schwarz.
Absorption von Licht
Wie wir in den vorhergehenden Kapiteln gesehen haben, hat jedes Atom ein charakteristisches Energieniveau-Schema. Dieses besteht aus den unterschiedlichen Orbitalenergien, die die Atomorbitale jeweils besitzen. das gleiche gilt für Moleküle. Hier sind die Energieniveauschemata allerdings noch komplizierter als bei einzelnen Atomen.
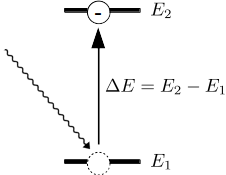
Wenn bei einer höheren Energie "noch ein Platz frei ist", dann kann ein Elektron in dieses "höhere" (höhere Energie) Orbital hineinspringen, wenn es von einem Lichtquant, einem Photon, getroffen wird. Allerdings muss dieses Photon die genau passende Energie haben, um den Energieunterschied der beteiligten Atomorbitale zu überwinden. Wenn die Energie passt, dann ist das Elektron im energetisch höherem Orbital und das Photon ist verschwunden - es wurde absorbiert.
Die Energie eines Photons, eines Lichtteilchens, hängt dabei nur von dessen Frequenz bzw. der Wellenlänge ab: 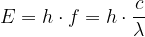 .
.
Schema der Absorption von Licht bei zwei Energieniveaus:
Farbe
Wenn ein Gegenstand alles Licht absorbiert, dann sieht er für uns schwarz aus. Wird Licht jeder Frequenz reflektiert, ist ein Gegenstand weiß.
In der Regel wird aber nur ein Teil des sichtbaren Lichtes absorbiert. Der Teil, der reflektiert wird, weil er nicht absorbiert wurde, verleiht einem Gegenstand seine Farbe.
Emission von Licht
Spontane Emission
Wenn ein Elektron durch äußere Energie auf ein angeregtes Energieniveau gebracht wurde, dann hat es Energie gespeichert. Aber es "möchte" in den energieärmeren Energiezustand wieder zurück. Das passiert in der Regel in Bruchteilen von Sekunden spontan. Wenn das Elektron wieder in das Energieärmere Energieniveau zurückfällt, dann wird Energie frei in Form von elektromagnetischer Strahlung - also Licht. Die Energie, die frei wird, entspricht genau dem Energieunterschied der beiden Energieniveaus.
Schema für spontane Emission:

Stimulierte Emission
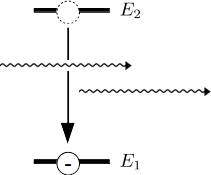
Es gibt angeregte Energieniveaus, in denen sich angeregte Elektronen etwas länger aufhalten können als in anderen. Man sagt diese Energieniveaus sind metastabil. Wenn ein Photon so ein angeregtes Elektron im metastabilen Zustand trifft, kann es zu stimulierter Emission kommen. Aber nur dann, wenn das ankommende Photon genau die gleiche Energie hat, wie die Energiedifferenz des metastabilen Energieniveaus E2 zum nicht angeregten Grundniveau E1. Dann fällt das angeregte Elektron aus dem metastabilen Energieniveau in den Grundzustand, erzeugt dabei ein Photon, das die gleiche Energie und die gleiche Phase hat wie das auslösende Photon und das auch in der gleichen Richtung weiterfliegt. Damit sind aus einem Photon zwei Photonen der gleichen Energie geworden, das Licht hat sich verstärkt. Da die beiden Photonen die gleiche Phase haben, schwingen sie parallel, man sagt sie sind kohärent.
Die folgende Abbildung ist eine schematische Abbildung so einer stimulierten Emission:
Stimulierte Emission ist die Voraussetzung für die Funktion von Lasern.
Backlinks:
2 Physikbücher:BGPhysik13-1
