11 Das Periodensystem der Elemente
Ein Atom besteht aus dem Atomkern und aus einer Elektronenhülle. Die Elektronen, die sich um den Atomkern herum befinden sind nicht mehr als Teilchen, sondern als Wellen zu betrachten. Sie halten sich in sogenannten Atomorbitalen auf. In jedes Atomorbital passen zwei Elektronen mit unterschiedlichem Spin.
Das Schachbrett-Schema
Atomorbitale unterscheiden sich durch ihre Quantenzahlen (siehe hier). Außerdem hat jeder Atomorbital seine eigene Energie. Die Orbitale werden von der niedrigsten Energie beginnend in der Reihenfolge wachsender Energie besetzt. Doch welches Energieorbital hat wie viel Energie? In welcher Reihenfolge werden die Obitale besetzt? Das kann man natürlich ausrechnen, aber es gibt ein schönes Schema in Form eines Schachbrettes, von dem man die Reihenfolge ablesen kann:

Von unten und dann jede Zeile von links nach rechts lesen, das hat die richtige Reihenfolge zum Ergebnis:
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, 8s usw.
Regeln zur Orbitalbesetzung
- Die freien Orbitale zu niedrigeren Energien werden zuerst besetzt.
- In jedem Atomorbital können sich höchstens zwei Elektronen aufhalten, eines mit der Spinquantenzahl s = 1/2 und eines mit der Spinquantenzahl s = -1/2.
- Hund‘sche Regel: Orbitale gleicher Energie werden zuerst alle von einem einzelnen Elektron besetzt. Wenn die drei p-Orbitale besetzt werden, dann werden zuerst das px, das py und das pz-Orbital mit jeweils einem Elektron besetzt, bevor das zweite Atom dazukommt. Bei den Raumrichtungen x, y und z gibt es keine vorgegebene Reihenfolge.
Keine Regel ohne Ausnahme: Auch bei der Besetzung der Atom,orbitale der Elemente gibt es ein paar Ausnahmen. Details dazu sind hier nachzulesen: https://www.cosmos-indirekt.de/Physik-Schule/Aufbauprinzip
Das Periodensystem der Elemente
Im Periodensystem der Elemente, oft auch nur Periodensystem genannt, werden die Atome nach zwei Kathegorien geordnet:
- Nach der Anzahl Protonen im Kern, welche auch der Anzahl Elektronen in der Hülle entspricht. Die Anzahl der Protonen steigt im Periodensystem von links nach rechts und von oben nach unten.
- Nach der chemischen Eigenschaft. Die Chemischen Eigenschaften eines Atoms wiederum hängen direkt mit der Besetzung der Atomorbitale zusammen. Für die Chemie sind insbesondere die Elektronen der Atomhülle wichtig, die sich auf der äußersten Schale befinden, also auf den Oritalen mit der höchsten Hauptquantenzahl. Wie viel Elektronen sich jeweils in welchem der äußersten Atomorbitale befinden, kann man an den Spalten des Periodensystems ablesen. Die Spalten des Periodensystems nennt man auch Perioden, weil ähnliche chemischen Eigenschaften sich in regelmäßigen Abständen (periodisch) wiederholen. In der ersten Spalte ist ein Elektron im s-Orbital, in der zweiten Spalte sind es zwei usw.
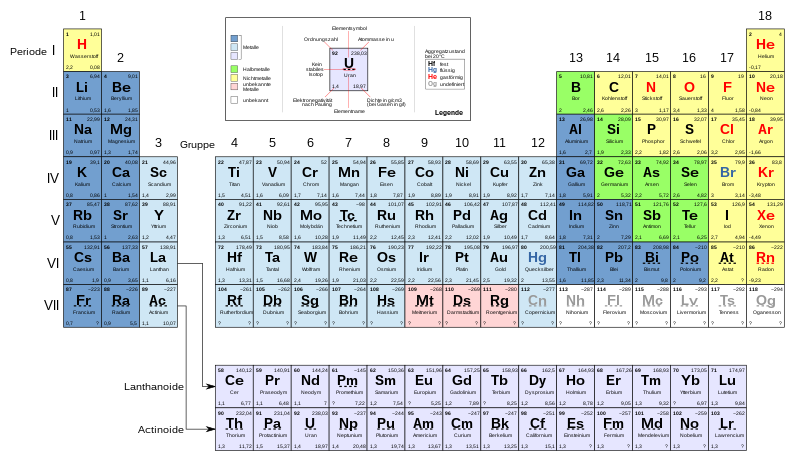
Oder in eier besseren Auflösung: ./2560px-Periodensystem_newdraft.svg.png (Quelle Wikipedia)
Elektronenkonfiguration
Jedes Element des Periodensystems hat also eine charakteristische Verteilung der Elektronen auf die Atomorbitale. Diese Verteilung nennt man Elektronenkonfiguration. Dabei steht die linke Zahl für die Hauptquantenzahl, dann kommt der Name des Orbitals (s,p,d...) und als Hochzahl ist vermerkt, wie viel Elektronen sich in diesen Orbitalen befinden.
Beispiele:
Wasserstoff: 1s1
Helium: 1s2
Chlor: 1s2 2s2 2p6 3s2 3p5
Gold: 1s2 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6, 6s2, 4f14, 5d9 (Reihenfolge der Orbitale, siehe Schachbrettmuster)
Backlinks:
2 Physikbücher:BGPhysik13-1
