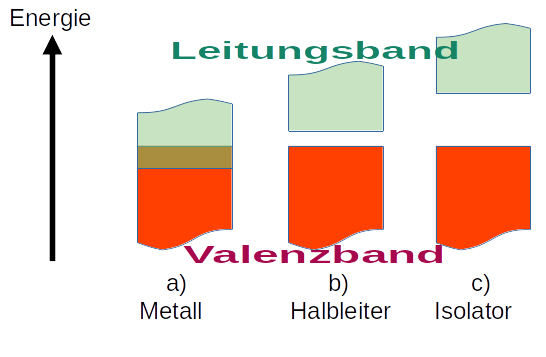
5.3 Energiebänder - Warum LEDs leuchten
Atome sind wie Hochhäuser ohne Fahrstuhl
Einzelne Atome bestehen aus einem Atomkern und einer Elektronenhülle. In dieser bewegen sich die Elektronen auf bestimmten Bahnen bzw. in bestimmten Räumen, die man Atomorbitale nennt. Verschiedene Atomorbitale haben verschiedene Energien.
Eine Elektronenhülle ist wie ein Hochhaus ohne Fahrstuhl. Niemand möchte oben wohnen, weil man dann so viele Treppen steigen muss. Die unteren Etagen werden daher zuerst besetzt. Genauso ist es bei Atomen, die inneren Energieorbitale mit den kleineren Energien werden zuerst von Elektronen besetzt. Allerdings passen in jedes Orbital nur 2 Elektronen, daher können nicht alle "unten wohnen". Man kann Elektronen dazu bringen, in höhere Stockwerke zu springen, wenn man ihnen Energie zuführt, durch Wärme, Licht oder elektrische Spannung.
In festen Körpern, Physiker sagen auch Festkörpern, sind viele Atome sehr nah beieinander. Ein Elektron kann daher nicht nur in ein höheres Stockwerk springen, es kann sogar das Hochhaus - also das Atom - wechseln, wenn dort noch "ein Zimmer frei ist". Wenn Elektronen nicht mehr an ein einzelnes Atom gebunden sind, sondern ihre Atomrümpfe auch wecheln können, dann spricht man nicht mehr von Atomorbitalern, in denen sich die Elektronen aufhalten, sondern von Energiebändern.
Das Valenzband
Das oberste Energieniveau, in dem sich ohne zusätzliche Energiezufuhr noch Elektronen aufhalten, heißt Valenzband. Im Hochhaus-Bild also das oberste bewohnte Stockwerk.
Das Leitungsband
Hier unterscheiden sich die Atomhochhäuser von denen in unserer Welt. Wenn man in der realen Welt von einem Hochhaus in ein anderes gehen möchte, dann muss man ganz nach unten auf die Straße gehen, um dann wieder hoch zu laufen.
Elektronen wecheln die Atome aber nicht über die unteren - besetzten - Energienieveaus. Wenn man ein Elektron in ein höheres Energieniveau anhebt, dann kann es mühelos von einem Atom auf ein anderes wecheln. Das "Stockwerk", in dem das möglich ist, nennt sich Leitungsband.
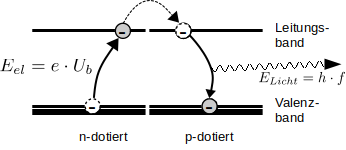
Im freien Fall vom Leitungsband in das Valenzband
Eine LED ist eine Diode (siehe 5.2 ) die in Durchlassrichtung betrieben wird. Dabei werden Elektronen aus dem n-dotierten Teil des Halbleiters von der angelegten Spannung vom Valenzband in das Leitungsband gehoben, wandern dann in das Leitungsband des p-dotierten Teils, wo sie mit den dort vorhandenen Löchern rekombinieren können und so vom Leitungsband in das Valenzband "herunterfallen". Dabei wird Energie frei. Dieser Energieunterschied zwischen Leitungsband und Valenzband wird von der LED als Photon, also als Licht, abgestrahlt.
Energiedifferenz Leitungsband-Valenzband = h · Frequenz des Photons oder ΔE = h · f
Allerdings kann eine LED nur leuchten, wenn die zugeführte elektrische Energie 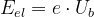 - zugeführt über die Betriebsspannung Ub ausreicht, um Elektronen im n-dotierten Teil der LED vom Valenzband in das Leitungsband zu heben (die Ladung eines Elektrons ist die Elementarladung e = -1,6022·10-19C ).
- zugeführt über die Betriebsspannung Ub ausreicht, um Elektronen im n-dotierten Teil der LED vom Valenzband in das Leitungsband zu heben (die Ladung eines Elektrons ist die Elementarladung e = -1,6022·10-19C ).
Die Farbe einer Leuchtdiode:
Die Energie des abgestrahlten Photons entspricht genau der "Energielücke" zwischen Leitungsband und Valenzband der Leuchtdiode. Wer eine LED einer bestimmten Farbe herstellen möchte, muss also ein Halbleitermaterial finden, das eine geeignete Energielücke hat. Das ist oft schwierig.
Backlinks:
2 Physikbücher:BGPhysik13-1:5 Funktionsweise einer LED
2 Physikbücher:BGPhysik13-1:6 h-Bestimmung mit LEDs
